内蒙古金源康生物工程股份有限公司品牌商
7 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
推荐产品
公司新闻/正文
人外周血来源巨噬细胞扩增培养实验方法的构建
701 人阅读发布时间:2024-09-04 17:30
1、实验目的:构建人外周血来源巨噬细胞扩增培养的实验方法
2、实验设计:
使用含有GM-CSF的1640完全培养基分离培养外周血PBMC来源的巨噬细胞,观察细胞贴壁形态及增值状况,以构建巨噬细胞扩增培养的实验方法。
3、实验材料
(1)试剂
0.9% NaCl注射液, 1X PBS, Ficoll淋巴细胞分离液, 1640基础培养基, 胎牛血清, 100X 青链霉素, 100x ITS, Y-27632, 100x NEAA, 100x L-谷氨酰胺, 50ug GM-CSF等。
(2)耗材
一次性使用真空采血管, 50ml离心管, 10ml移液管, 1000ul枪头, 200ul枪头, T25培养瓶等。
(3)仪器设备
离心机, 超净工作台, 细胞计数仪, 电子移液器, 1000ul手动移液器, 200ul手动移液器等。
(3)细胞来源
外周血PBMC
4、实验方法
(1)溶液配置:
GM-CSF:使用移液枪吸取1ml超纯水至50ug GM-CSF中,溶解GM-CSF粉末至50ug/ml,吸取部分体积的50ug/ml GM-CSF溶液用水稀释至10ug/ml,分装为200ul/管,放置于-20℃冰箱。
RPMI-1640完全培养基配置:RPMI-1640+10% FBS+1% P/S+1x NEAA+1x L-谷氨酰胺+10 umol/L Y-27632+1x ITS+20 ng/ml GM-CSF。
(2)样本采集及预处理
采集新鲜的外周血40mL,经75%的酒精处理后置于超净工作台中;
每10mL外周血转入50mL离心管中;
1500rpm,10min离心,收集所有血浆于50mL离心管中置于4℃备用;
3管红细胞分别加入等体积的0.9%NaCl注射液、PBS溶液、Hank ’S溶液后混匀备用;
取3个50mL离心管分别加入5mL淋巴细胞分离液,将混匀后的含有红细胞的0.9%NaCl注射液、PBS溶液、HAKS溶液分别缓慢加入含有淋巴细胞分离液的离心管中;
650g,30min,升0降0离心;
离心后从上至下依次为血浆层、白膜层、淋巴细胞分离液层、红细胞层,分别收集血浆层及白膜层置于15mL离心管中;
600g,10min离心;
收集细胞沉淀,加入0.9%NaCl注射液至10mL;
400g,10min离心;
收集细胞沉淀,分别加入1mL 1640基础培养基重悬细胞进行计数。
(3)细胞培养
使用含有GM-CSF的1640完全培养基诱导巨噬细胞形成,显微镜下观察细胞贴壁形态。
5. 实验结果
(1)细胞形态
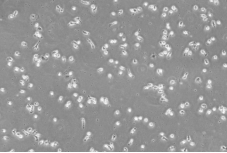
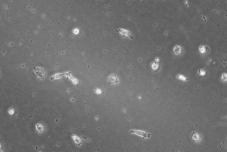
观察含有GM-CSF的1640完全培养基中细胞贴壁形态,发现在培养5d后,细胞开始贴壁,且细胞形态接近巨噬细胞。因此,初步确定含有GM-CSF的1640完全培养基能够刺激PBMC细胞分离形成巨噬细胞。
|
5d时细胞生长形态(100X) |
5d时细胞生长形态(200X) |
图1 细胞生长5d时细胞贴壁形态
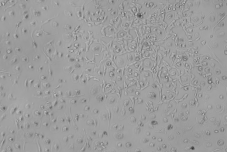
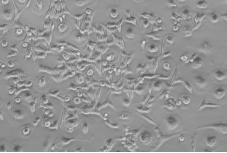
连续培养14d后,发现巨噬细胞逐渐增多,可判断含有GM-CSF的1640完全培养基能够促进巨噬细胞增值。
|
14d时细胞生长形态(100X) |
14d时细胞生长形态(200X) |
图2 细胞生长14d时细胞贴壁形态
再次对细胞进行传代,发现细胞在培养6天后,细胞分裂增值。
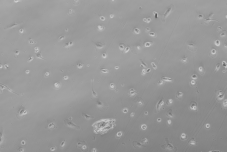
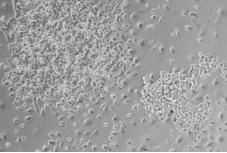
|
P2代细胞24h细胞生长形态(100X) |
P2代细胞6d时细胞生长形态(100X) |
图3 细胞传代后贴壁形态
(2)细胞数量及活率
对细胞进行了2代细胞数量及活率测定,结果如下
表1 人血液来源巨噬细胞数量及活率测定
|
代次 |
细胞数量/T25瓶 |
细胞活率 |
|
P1 |
3.21x106 |
88.47% |
|
P2 |
6.60x106 |
93.66% |
通过对细胞数量及活率测定,可看到人血液来源巨噬细胞传代培养两代后活率均可达85%以上,且细胞生长状态良好,可进行传代扩增培养。
6. 结论
采用含有GM-CSF的1640完全培养基(BS-1105)可有效从外周血PBMC来分离培养出巨噬细胞。






